Équipe
Génétique de la suppression tumorale
Axes de recherche thématiques :
Image

To top
Équipe
FRANCK TOLEDO
Génétique de la suppression tumorale
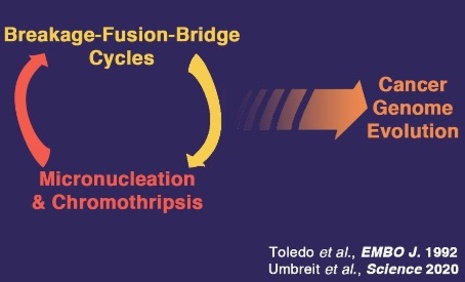
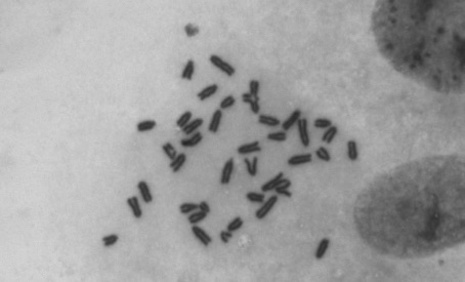
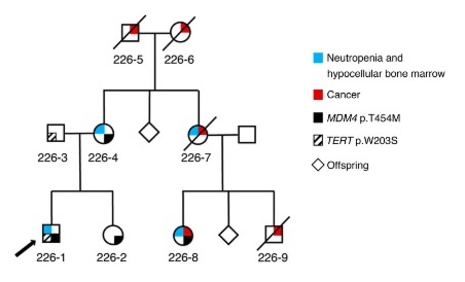
La voie p53 est altérée dans la plupart, si ce n’est la totalité des tumeurs. Dans la moitié des cancers humains le gène de p53 est muté et, dans l’autre moitié, la protéine p53 peut être inactivée par la surexpression de l’un de ses inhibiteurs spécifiques, MDM2 ou MDM4.
Membres
Publications clés
Toutes les publications
-
p53 in the Molecular Circuitry of Bone Marrow Failure SyndromesInternational Journal of Molecular Sciences
-
A systematic approach identifies p53-DREAM pathway target genes associated with blood or brain abnormalitiesDisease Models & Mechanisms
-
-
p53 downregulates the Fanconi anaemia DNA repair pathwayNature Communications
-