- Accueil >
- Les actualités de l'Institut Curie >
- Nouvelles perspectives sur les propriétés matérielles et le déplacement des cellules
La migration cellulaire ne se limite pas à ces processus ; elle joue également un rôle dans des maladies comme le cancer, où elle peut favoriser la propagation des tumeurs. Dans une nouvelle étude publiée dans Developmental Cell, le Dr Matthieu Piel (CNRS UMR144 / Sorbonne Université / Institut Curie), et le Dr Raphaël Voituriez (CNRS UMR8237 / Sorbonne Université / Laboratoire de Physique Théorique de la Matière Condensée) proposent un cadre universel pour comprendre la migration cellulaire « amiboïde » – un type de mouvement qui se fait sans que la cellule s'attache à des surfaces, particulièrement important pour les cellules immunitaires et cancéreuses.
Les cellules animales, bien que souvent stationnaires dans leur tissu, possèdent une capacité intrinsèque à se déplacer. Ce type de mouvement est essentiel pour des processus comme le développement embryonnaire, la cicatrisation et les réponses immunitaires, mais il peut aussi être détourné dans le cancer, permettant aux cellules de se propager dans tout le corps. La migration des cellules dites amiboïdes* est un processus complexe qui repose sur les « muscles » cellulaires (le cytosquelette d'actomyosine) et d’autres facteurs.
Le déplacement des cellules amiboïdes
L’étude menée par le Dr Matthieu Piel (CNRS UMR144 / Sorbonne Université / Institut Curie) et le Dr Raphaël Voituriez (CNRS UMR8237 / Sorbonne Université / Laboratoire de Physique Théorique de la Matière Condensée) révèle que les cellules amiboïdes, au lieu de contenir un squelette homogène, divisent leur structure interne « musculaire » en trois régions distinctes, chacune ayant des propriétés spécifiques qui aident la cellule à se déplacer.
« Jusqu'à présent, la plupart des recherches supposaient que les cellules amiboïdes contenaient un réseau unique et uniforme d'actine et de myosine », explique le Dr Juan Manuel García-Arcos, 1er auteur de l’étude, ex-doctorant dans l’équipe de Matthieu Piel et post-doctorant à l’Université de Genève. « Nous avons découvert au contraire que ces cellules créent des zones distinctes : un avant souple ou mou qui se déforme pour se faufiler dans les petits espaces, un centre rigide pour maintenir la forme, et un arrière qui sert de ‘muscle’ pour pousser la cellule en avant. Cette organisation permet aux cellules de générer de la force et de se déplacer efficacement. »
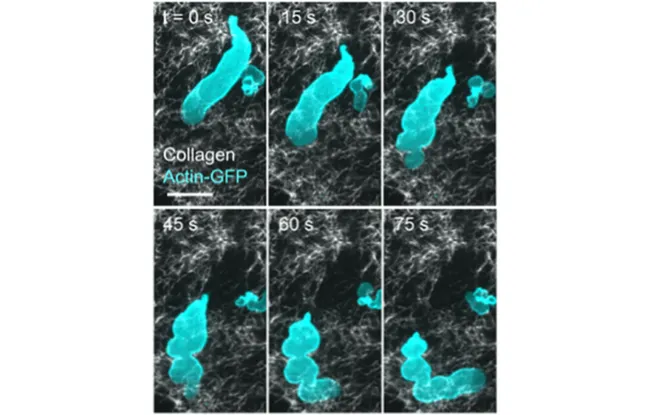
Pour explorer la migration amiboïde, les chercheurs ont créé un modèle cellulaire simplifié dans lequel des cellules humaines confinées ont formé des « blebs » ou protubérances qui se détachent finalement en petits fragments mobiles. Ces fragments imitent le comportement cellulaire réel, avec des structures d’actine et de myosine organisées soutenant un mouvement indépendant. Ce modèle a permis à l'équipe d’observer comment ces réseaux de « muscles » cellulaires interagissent pour propulser le mouvement.
La fragmentation, moteur de la propagation des cellules
Cette étude va encore plus loin en apportant un nouvel éclairage sur un processus appelé fragmentation cellulaire – lorsque les cellules se divisent en petits morceaux mobiles. Observée ici pour la première fois dans un environnement contrôlé, la fragmentation semble être une conséquence naturelle du mouvement amiboïde confiné. Cette découverte fait écho aux études récentes de microscopie dans les tumeurs vivantes, où les scientifiques ont observé en temps réel des cellules cancéreuses se fragmenter, des morceaux se détachant et se déplaçant indépendamment dans les tissus.
Les implications sont profondes. La capacité des cellules à se fragmenter et à produire des fragments mobiles capables de se déplacer dans l'organisme pourrait expliquer comment les cellules cancéreuses se propagent plus facilement, ou comment les cellules immunitaires se mobilisent pour combattre les infections. Chaque fragment conserve une structure interne organisée, ce qui lui permet de se déplacer de manière autonome. Cette découverte élargit notre compréhension de la migration cellulaire et ouvre de nouvelles voies pour étudier la métastase du cancer et le comportement des cellules immunitaires. Cette avancée suggère que cibler les mécanismes derrière la fragmentation cellulaire pourrait conduire à de nouvelles thérapies visant à limiter la propagation du cancer ou à améliorer les réponses immunitaires, offrant ainsi une nouvelle perspective pour contrôler ces processus en santé et en maladie.
*type de cellules qui peuvent changer de forme : les cellules immunitaires comme les macrophages par exemple, sont des cellules amiboïdes, ce qui leur permet de se mouvoir dans les tissus, ou d’effectuer des fonctions comme la phagocytose.
Publication: https://doi.org/10.1016/j.devcel.2024.06.023
Video: https://youtu.be/bgwz0PbiQFQ
Référence : Juan Manuel García-Arcos, Johannes Ziegler, Silvia Grigolon, Loïc Reymond, Gaurav Shajepal, Cédric J Cattin, Alexis Lomakin, Daniel J Müller, Verena Ruprecht, Stefan Wieser, Raphael Voituriez, Matthieu Piel
Rigidity percolation and active advection synergize in the actomyosion cortex to drive amoeboid cell motility. Developmental Cell, 2024 July 20 doi : 10.1016/j.devcel.2024.06.023
Cette séquence d'images prises avec un microscope de fluorescence montre la dynamique de l'actine (en cyan) et des fibres de collagène de la matrice extracellulaire (en blanc). On observe un petit fragment de cellule, marqué par l'actine, qui se détache de la structure principale et se déplace indépendamment à travers le réseau de collagène. La barre d’échelle représente 10 micromètres.