Présentation

Au cours du développement, la formation de tissus et d'organes repose sur deux processus clés : la prolifération cellulaire et la morphogenèse ; la prolifération modulant la taille des cellules et la morphogenèse définissant la forme des tissus. De manière intéressante, des progrès récents en imagerie ont mis en évidence une coordination spatiale et temporelle entre ces deux processus : du stade le plus précoce du développement embryonnaire aux stades ultérieurs au cours desquels la dynamique collective de milliers de cellules en division et en mouvement promeut l'émergence de tissus et d'organes. À l’opposé, la dérégulation de la morphogenèse ou de la prolifération est associée à des pathologies telles que le cancer.
Nos travaux visent à comprendre les mécanismes biochimiques et biomécaniques qui sous-tendent de morphogenèse et de prolifération dans les tissus épithéliaux. Nous explorons ces mécanismes chez la drosophile dans l’épithélium du thorax dorsal. Cet épithélium monocouche composé de plus de 10 000 cellules joue un rôle déterminant dans la découverte de processus fondamentaux tels que la régulation de l’expression génétique, la mécanique tissulaire, la division et la polarisation cellulaire. Au cours de son développement, il est prolifère de manière importante tout en étant le siège de plusieurs mouvements morphogénétiques. Ce tissu offre donc un système idéal pour déchiffrer les processus génétiques, mécaniques et auto-organisé qui contrôlent la prolifération et la morphogenèse. En utilisant des méthodes avancées d'imagerie, de génétique, de biophysique et de bioinformatique, notre travail s'articule autour de deux thèmes principaux : i) nous explorons comment les cellules se divisent dans un tissu épithélial et comment l’intégrité du tissu est maintenue lors de la division ; ii) nous déchiffrons comment l'expression génétique, la polarité des tissus et les forces mécaniques sous-tendent la dynamique collective de milliers de cellules et l’émergence de formes variées. Nos travaux ont en particulier mis en lumière les rôles clé de gènes suppresseurs de tumeur ou de proto-oncogènes dans la morphogenèse épithéliale et le contrôle des forces mécaniques, ouvrant ainsi la voie à une meilleure compréhension des défauts d’architecture observés dans les tissus tumoraux.
Comprendre la division cellulaire au sein des tissus épithéliaux
Lors de la division cellulaire, le maintien de l’intégrité du génome nécessite l'assemblage du fuseau mitotique et le processus de cytokinèse. De plus, au sein des les tissus épithéliaux, la division est étroitement régulée afin de maintenir l'organisation du tissu et de lui permettre de remplir sa fonction de barrière avec le milieu extérieur. Ainsi, le fuseau mitotique des cellules épithéliales est orienté dans le plan du tissu et la cytokinèse est couplée à un processus de repolarisation épithéliale. L’orientation du fuseau et la repolarisation des cellules sont essentielles pour prévenir les défauts de positionnement des cellules et de formation des jonctions, respectivement ; défauts observés au sein des tissus tumoraux.
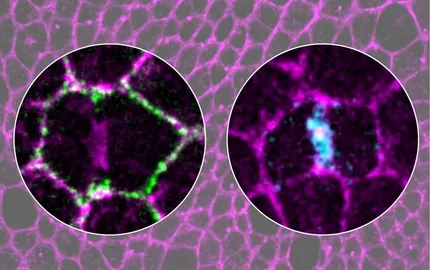
En étudiant l'orientation du fuseau et la cytokinèse, nous avons découvert de nouvelles lois régissant la division cellulaire et mis en lumière que la division cellulaire est un processus multicellulaire. En effet, au sein des tissus épithéliaux, la division cellulaire implique un « dialogue » biochimique et biomécaniques entre la cellule en division et ses voisines. Ce dialogue repose en partie sur les jonctions dites tricellulaires car elles se trouvent à l’interception de 3 cellules et les fibres de stress. En utilisant des méthodes avancées d’imagerie et des approches optogénétiques, nous explorons actuellement les mécanismes biochimiques et biomécaniques qui sous-tendent le caractère multicellulaire des divisions épithéliales et qui permettent d’assurer la communication entre cellules au niveau des jonctions tricellulaires. Nos travaux apporteront donc une compréhension nouvelle des mécanismes fondamentaux de la division cellulaire dont la dérégulation est à l’origine de processus tumoraux.
Lier l'expression des gènes, la dynamique cellulaire et les forces mécaniques
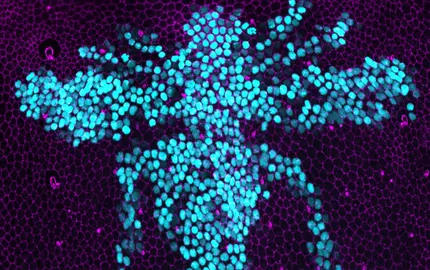
Comprendre les mécanismes contrôlant prolifération et morphogenèse à l’échelle de tout un tissu nécessite une étude interdisciplinaire visant à intégrer régulation génétique, dynamique du cytosquelette et forces mécaniques. Pour réaliser cette étude intégrée, nous développons d’une part des méthodes avancées de transcriptomique spatiale pour définir de manière exhaustive tous les patrons d’expression géniques susceptibles de réguler l'organisation du cytosquelette et les forces mécaniques dans le thorax dorsal de la drosophile. D’autre part, nous explorons comment les contraintes mécaniques et la géométrie cellulaire modulent en retour l'expression génique, la prolifération ainsi que l’apoptose. Nous avons ainsi récemment découvert une propriété fondamentale de la réponse mécanique cellulaire qui intègre force mécanique et taille cellulaire. Nous explorons maintenant comment les cellules mesurent leur taille pour adapter leur expression génique et leur réponse mécanique. Ces travaux qui couvrent des échelles subcellulaire, cellulaires et tissus sont rendus possibles par l’utilisation et le développement de méthodes innovantes de transcriptomique spatiale, d'optogénétique, de biologie quantitative et de la modélisation physique. Nos travaux devraient à terme concourir à une vision intégrée des régulations génétiques, biochimiques et biomécaniques qui façonne les tissus au cours de leur développement pour produire des organes de formes complexes.