- Accueil >
- Les actualités de l'Institut Curie >
- Le cancer sous pression
Venant initialement de la physique, je n’aurais jamais imaginé que nous trouverions une implication aussi forte de la mécanique dans la physiopathologie du cancer et potentiellement utile à la médecine
confie Emmanuel Farge, directeur de recherche Inserm et responsable de l’équipe Mécanique et génétique du développement embryonnaire et tumoral (CNRS UMR168 / Sorbonne Université) à l’Institut Curie.
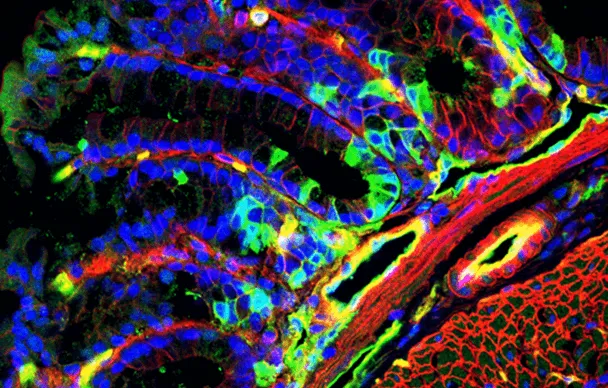
Et pourtant, avec ses collègues, il met en évidence un rôle étonnant de la pression mécanique sur le développement du cancer du côlon chez la souris. Une découverte qui fait émerger de nouvelles pistes thérapeutiques pour de nombreux types de cancers chez l’humain.
Deux fois plus de cellules souches
Emmanuel Farge, en collaboration avec Maria Elena Fernández-Sánchezet ses équipes, a découvert que l’activation mécanique d’une voie biochimique appelée ß-caténine par les contractions naturelles du côlon est nécessaire au maintien de la quantité physiologique de cellules souches dans le côlon et que, en revanche, la suractivation de cette voie par la pression permanente de croissance d’une tumeur entraîne un doublement pathologique du nombre de cellules souches et prolifératives. Ils ont aussi mis en évidence une augmentation des marqueurs de cellules souches cancéreuses, signe que l’hyperprolifération semble s’accompagner d’une capacité des cellules à envahir les tissus et à résister aux traitements.
Ils ont donc poursuivi leur exploration des mécanismes biologiques impliqués et ont confirmé in vivo qu’une protéine appelée Ret kinase joue un rôle en amont de la voie ß-caténine chez la souris. De son côté, l’équipe de Didier Meseure, responsable médical de la plateforme de pathologie expérimentale Pathex, du Pôle de médecine diagnostique et théranostique (PMDT) de l’Ensemble hospitalier de l’Institut Curie, a confirmé que cette même voie biochimique était suractivée dans des cellules de cancers du côlon humain et que cette surexpression était également présente dans neuf autres tumeurs solides malignes. Ces observations pourraient déboucher sur des thérapies ciblées pour de nombreux types de cancers, particulièrement ceux de l’ovaire, du poumon et du pancréas, de mauvais pronostic. Dans cette perspective, les chercheurs ont testé in vivo avec succès la résorption de moitié de tumeurs spontanées intestinales chez les souris par traitement avec des molécules connues pour bloquer la Ret kinase. Comme de nombreux inhibiteurs, ces molécules sont aussi connues pour leur forte toxicité. Ce qui anime maintenant Emmanuel Farge et ses collègues :
il nous faut trouver les moyens d’agir sur Ret de façon moins ou non toxique pour l’ensemble de l’organisme
indique-t-il.
Pression mécanique et cancer
Il y a une vingtaine d’années, Emmanuel Farge avait soupçonné l’effet de pressions mécaniques sur la différentiation cellulaire, c’est-à-dire sur l’acquisition de fonctions spécifiques à chaque type de cellules, et avait pu le vérifier avec son équipe pendant le développement embryonnaire. Il avait aussi dressé un parallèle possible avec la formation de tumeurs cancéreuses, la confirmation de ce parallèle ayant mené à une publication dans la revue Nature. Dans des travaux antérieurs, son équipe avait aussi mis en évidence une voie biochimique impliquée dans ces phénomènes de « mécanosensibilité » (ou de mécanotransduction), une voie appelée Wnt/ß-caténine.
Références
Communications Biology
https://doi.org/10.1038/s42003-022-03079-4
Ret kinase-mediated mechanical induction of colon stem cells by tumor growth pressure stimulates
cancer progression in vivo
Thanh Huong Nguyen Ho-Bouldoires 1,8, Kévin Sollier 1,8, Laura Zamfirov 1,2,8, Florence Broders-Bondon 1,8, Démosthène Mitrossilis 1,3, Sebastian Bermeo 1, Coralie L. Guerin 4, Anna Chipont 4, Gabriel Champenois 5, Renaud Leclère 5, Nicolas André5, Laurent Ranno 6, Aude Michel 7, Christine Ménager 7, Didier Meseure 5, Charlie Demené 2, Mickael Tanter 2, Maria Elena Fernández-Sánchez 1,9✉ & Emmanuel Farge 1,9✉
1 Institut Curie, Université PSL, Sorbonne Université, CNRS UMR 168, Laboratoire de Physico-Chimie Curie, Mechanics and Genetics of Embryonic and Tumoral Development team, INSERM, F-75005 Paris, France.
2 Physics for Medicine Paris, ESPCI ParisTech, PSL Research University, Inserm U1273, F-75005 Paris, France. 3 Biomedical Research Foundation of the Academy of Athens, 4 Soranou Ephessiou St., 115 27 Athens, Greece.
4 Cytometry Platform, Institut Curie, Paris, France.
5 Platform of Investigative Pathology, Institut Curie, 75248 Paris, France.
6 NEEL Institut, CNRS, Grenoble Alpes University, F-38042 Grenoble, France.
7 Sorbonne Université, Laboratoire PHENIX Physico-chimie des Electrolytes et Nanosystèmes Interfaciaux, CNRS UMR 8234, F-75005 Paris, France.
8 These authors contributed equally: Thanh Huong Nguyen Ho-Bouldoires, Kévin Sollier, Laura Zamfirov, Florence Broders-Bondon.
9 These authors jointly supervised this work: Maria Elena, Fernández-Sánchez, Emmanuel Farge. ✉email: maria-elena.fernandez-sanchez@curie.fr; emmanuel.farge@curie.fr