- Accueil >
- Les actualités de l'Institut Curie >
- Une protéine humaine héritée des bactéries révèle un pan méconnu de notre immunité
Et si les bactéries détenaient les clés d’une partie de notre propre immunité ? Depuis quelques années, certains scientifiques explorent les liens inattendus entre les protéines humaines impliquées dans la défense de l’organisme et certains mécanismes immunitaires bactériens. C’est le cas d’une équipe de scientifiques de l’Institut Curie, de l’Institut Pasteur et de l’Inserm qui vient d’identifier une protéine chez l’humain au rôle jusque-là méconnu : SIRal, dérivée d’un domaine bactérien dit « ancestral immun ». Publiés dans Science le 24 juillet 2025, leurs travaux révèlent un principe de conservation biologique qui ouvre de nouvelles voies en immunothérapie en proposant des cibles thérapeutiques d’un genre nouveau issues de l’évolution bactérienne elle-même.
Pendant longtemps, les scientifiques considéraient avoir identifié chez l’humain l’essentiel des voies de l’immunité innée qui constitue la première ligne de défense de l’organisme. En effet, l’immunité innée permet de détecter certains agents pathogènes et de déclencher une réponse rapide. Pourtant aujourd’hui, l’immunité ancestrale, un champ de recherche en pleine expansion remet en cause ce dogme. En explorant les liens évolutifs entre protéines bactériennes et humaines, les chercheuses et chercheurs comprennent qu’un nombre non négligeable de protéines impliquées dans l’immunité innée chez l’humain dérivent de celles présentes chez des bactéries. Ces protéines ne sont pas seulement conservées sur le plan structural : leur rôle immunitaire est lui aussi préservé, parfois sur des milliards d’années.
L’immunité ancestrale, mise en lumière par SIRal
Chez les bactéries, le domaine protéique SIR2 (silent information regulator 2) joue un rôle clé dans les systèmes de défense contre les phages, des virus qui infectent spécifiquement les bactéries. Lorsqu’un phage pénètre dans une bactérie, SIR2 déclenche la dégradation d’une molécule essentielle au métabolisme cellulaire et provoque la mort de la cellule infectée, protégeant ainsi le reste de la colonie.
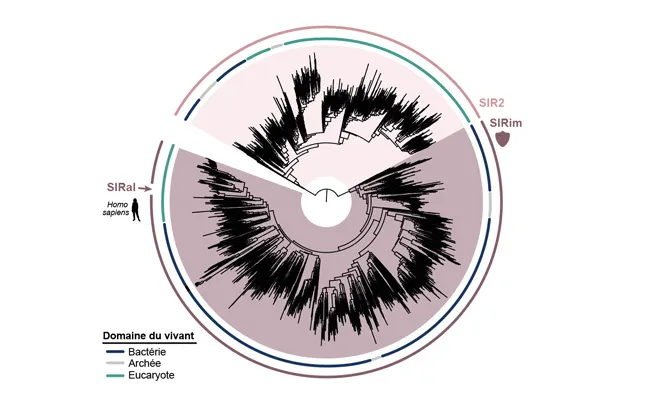
En reconstituant l’histoire évolutive des gènes par phylogénie1, une équipe menée par le Dr Enzo Poirier, chercheur à l’Inserm, chef d’équipe à l’Institut Curie dans l’unité Immunité et Cancer (Institut Curie, Inserm) et la Dr Aude Bernheim, responsable de l’unité Diversité moléculaire des microbes à l’Institut Pasteur ont mis en évidence chez l’humain un homologue du domaine SIR2, nommé SIRal et ont démontré son rôle dans l’immunité innée ainsi que sa capacité à dégrader le NAD, une molécule essentielle au métabolisme cellulaire et à la production d’énergie.
La découverte du rôle biologique de SIRal est d’autant plus intéressante qu’elle ne concerne pas une seule protéine isolée mais une famille diversifiée de protéines que l’on retrouve dans 19 % des génomes eucaryotes analysés, répartis en cinq grandes lignées. Ces résultats confirment que des mécanismes immunitaires d’origine bactérienne sont non seulement présents, mais largement conservés au sein du vivant, avec des implications potentielles pour l’ensemble des eucaryotes, y compris chez l’humain.
En plus de l’approche phylogénétique, la Dr Delphine Bonhomme (équipe E.Poirier), Hugo Vaysset (équipe Bernheim) et leurs collègues ont démontré que SIRal agit comme un régulateur central de la voie des récepteurs TLR (Toll-like receptors), une famille de récepteurs capables de détecter des signaux typiques des agents pathogènes. Ainsi, cette voie TLR régulée par SIRal facilite l’expression des gènes pro-inflammatoires et déclenche la réaction immunitaire. Ils ont montré que sans SIRal, la réponse inflammatoire est fortement altérée, que ce soit face à une infection bactérienne ou virale.
« Avec SIRal, nous montrons que des éléments hérités des bactéries peuvent jouer un rôle central dans les mécanismes immunitaires eucaryotes, et notamment humains. Mais plus largement, l’immunité ancestrale nous donne accès à un réservoir insoupçonné de mécanismes immunitaires », souligne Enzo Poirier, chercheur à l’Inserm et chef d’équipe à l’Institut Curie.
« Cette découverte illustre à quel point l’évolution réutilise d’anciennes briques pour créer de nouvelles fonctions : des mécanismes nés chez les bactéries il y a des milliards d’années façonnent encore aujourd’hui notre immunité », précise Aude Bernheim, responsable de l’unité Diversité moléculaire des microbes à l’Institut Pasteur.
Une cible thérapeutique prometteuse
Au-delà de la biologie évolutive, les implications de la découverte de SIRal sont cliniques. En effet, de nombreuses pathologies auto-immunes dépendent en partie de l’activation des récepteurs TLR. SIRal représente donc une cible thérapeutique inédite, ouvrant la voie à des immunothérapies d’un nouveau genre.
1La phylogénie désigne l’étude des liens évolutifs entre les espèces, visant à reconstituer leurs relations de parenté à partir d’un ancêtre commun.
Projet à suivre > EvoCure : cartographier les héritages bactériens de l’immunité
En 2025, le projet EvoCure, un consortium de 5 équipes dirigé par le Dr Enzo Poirier et la Dr Aude Bernheim, a été sélectionné pour un financement de 3 millions d’euros sur 48 mois pour explorer les mécanismes immunitaires ancestraux communs aux bactéries et eucaryotes. Objectif : identifier de nouvelles protéines immunitaires, modulables en thérapeutique, pouvant ouvrir la voie à des traitements innovants. Le projet EvoCure s’inscrit dans le cadre du programme Impact Santé lancé en 2024 par l’Inserm et financé par France 2030.

Arbre phylogénétique construit à partir de protéines à domaine SIR2 bactériennes (bleu) et eukaryotes (vert). Les protéines se répartissent en deux sous-familles, dont une, les sirims, contient les protéines SIR2 immunitaires, et notamment SIRal.
Référence
A human homolog of SIR2 antiphage proteins mediates immunity via the TLR pathway. Delphine Bonhomme, Hugo Vaysset, Eirene Marie Q. Ednacot, Vasco Rodrigues, Yazan Saloum, Jean Cury, Axel Benchetrit, Pierre Affaticati, Veronica Hernandez Trejo, Paul Vittot, Charlie Bories, Alexis Cornec, Jean-Pierre Levraud, Pedro P. Hernández, Philippe Benaroch, Benjamin R. Morehouse, Aude Bernheim & Enzo Z. Poirier. Science, le 24 juillet 2025.