Présentation

Le groupe « Mécanique et Génétique du Développement Embryonnaire et Tumoral » étudie le rôle des contraintes et déformations mécaniques des structures biologiques à l’échelle macroscopique cellulaire et multi-cellulaire, dans la régulation et la génération de processus biologiques actifs microscopiques à l’échelle moléculaire, incluant l’activation de moteurs moléculaires ou l’expression génique, in vivo.
Le groupe a trouvé que les contraintes mécaniques peuvent contrôler la différentiation cellulaire, et se focalise sur le couplage entre contraintes mécaniques et signalisation biochimique en biologie du développement embryonnaire et tumoral.
L'équipe se concentre de même sur l'émergence des premiers patterns morphologiques et biochimiques à l'origine des premiers métazoaires il y a plus de 600 millions d'années. Les résultats expérimentaux de l'équipe les suggèrent comme réponse comportementale mécanotransductionelle nutritionnelle primitive des colonies multicellulaires pré-métazoaires, aux contraintes hydrodynamiques environnementales des flux marins.
Nos travaux vont du contrôle mécanique de la trans-différentiation cellulaire par la modulation mécanique de l’endocytose de protéines de signalisation (2002), à son rôle comme signal mécanique d’activation de l’invagination du mésoderme dans l’embryon de Drosophile (2009, 2017).
Ils sont aussi basés sur notre découverte de l’induction mécanique de la différentiation précoce de l’endoderme antérieur de l’embryon de Drosophile via mécano-sensibilité de la voie β-caténine (2003-2008), possiblement impliquée dans l'origine évolutive de l’émergence de l'endomésoderme et des premiers métazoaires (2013, 2022), un processus réactivé de façon anormale comme signal tumorigène dans les cellules saines comprimées par la pression de croissance tumorale, in vivo (2015).
La gastrulation et la formation du mésoderme sont activés mécanotransductionellement par de faibles fluctuations de forme cellulaires embryonnaires.
La gastrulation consiste en la formation de larges domaines de tissus qui internalisent l’embryon précoce souvent sous forme de tubes, et qui vont constituer les organes internes de l’animal adulte, tels que le tube digestif, ou encore le cœur, les muscles ou les reins et les poumons pour les organismes les plus complexes. Dans l’embryon de Drosophile, le premier de ces tubes, le mésoderme, donnera naissance à tous les organes internes de l’organisme adulte, excepté le tube digestif. Il se forme grâce à la stabilisation apicale (à la surface cellulaire extérieur de l’embryon) du moteur moléculaire Myo-II, ayant pour fonction de contracter la surface externe du tissu, et par là même d’induire la courbure du tissu vers l’intérieur pour former le tube de tissu interne mésodermal. Cette contraction se fait en deux temps. Dans un premier temps, les cellules contractent de façon erratique et instable, du fait de l’arrivée erratique et instable de spots de Myo-II sur les apex cellulaires. Puis, elles se contractent de façon stable et coordonnée, du fait de la stabilisation des spots de Myo-II qui arrivent progressivement sur les apex cellulaires.
Nous avons montré que les contraintes mécaniques développées par les fluctuations de forme cellulaires activent la transition vers la phase de stabilisation apicale de la Myo-II, donc déclenchent le processus actif d’invagination du mésoderme (Mitrossilis et al, Nature Communications 2017).
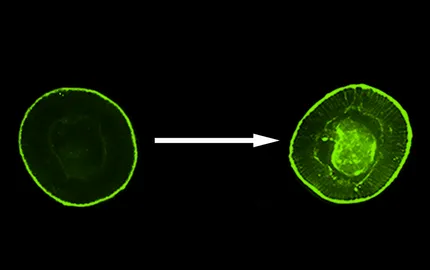
Pour ce faire, nous avons utilisé un mutant de snail dont les cellules du mésoderme ne fluctuent plus, et ne montre de fait plus d’activation de l’invagination du mésoderme. Nous y avons mimé les fluctuations de forme des apex cellulaires dont l’amplitude est de l’ordre de 500 nanomètres seulement, par voie magnétique. En effet, nous avons injecté dans les cellules du mésoderme des liposomes magnétiques et avons approché à quelques petits microns un réseau de micro-aimants dont la taille individuelle, de 10 microns, est de l’ordre de la taille des cellules individuelles. Le champ magnétique local de ces micro-aimants ayant la particularité d’être modulable dans le temps, nous avons fait osciller les champs magnétiques micrométriques locaux, de telle sorte que les apexs des cellules se mettent à pulser, exactement comme dans l’embryon non muté (Figure 1-gauche). En réponse à cette stimulation mécanique, nous avons observé la stabilisation apicale de la Myo-II et le déclenchement de l’invagination du mésoderme (Figure 1-droite). Cette stimulation se fait par l’activation mécanique de réactions biochimiques, que nous avons identifié comme étant l’activation de la voie de signalisation Fog.
Qui plus est, nous avons montré, par l'utilisation d'outils génétiques et magnétiques encore, que les déformations mécaniques, cette fois provoquées par l’invagination du mésoderme sur les cellules de l’endoderme du pole postérieur de l’embryon (futur tube gastrique postérieur de l’embryon), y déclenchent la stabilisation apicale de la Myo-II et initient la formation du tube gastrique (Mitrossilis et al, Nature Communications 2017).
Une cascade d'évènements mécanotransductionels, déclenchée par les fluctuations de forme d'apex cellulaires dans le mésoderme, est donc à l'origine des mouvements morphogénétiques de gastrulation du mésoderme et de l'endoderme dans l'embryon de Drosophile.
De plus, nous trouvons que Twist, le produit du gène initiant la spécification du mésoderme, est mécaniquement induit par le mouvement morphogénétique de la gastrulation. En effet, chez les mutants de snail non gastrulés, l'expression de Twist est fortement réduite par rapport au WT (Figure 1B Gauche). Chez les mutants de snail stimulés mécaniquement pour rétablir l'invagination (voir Fig.1A et Fig.6), le l’expression de la protéine Twist (voir Fig.5A) est sauvé (Figure 1B - droite) (Bouclet, Brunet et al, Nature Comm. 2013). Il est intéressant de noter que Twist est exprimé dans les cellules ayant une invagination seulement : dans le cas où l'invagination sauvée est plus petite que celle du WT (Fig. 1B en bas à droite), le sauvetage de Twist est observé dans le petit tissu invaginant seulement. Cela indique que la mécanosensibilité de Twist est un coordinateur de la morphogenèse biomécanique et biochimique dans le développement embryonnaire : seules les cellules ayant subi une invagination mécanique se différencieront finalement en mésoderme, de sorte que le mésoderme ne se développera pas en dehors des embryons par accident en cas de fluctuation du nombre de cellules ayant subi une invagination pendant la gastrulation.
Les contraintes mécaniques de la gastrulation provoquent l’ouverture du site Y654 de la béta-caténine, site majeur d’interaction avec la E-cadhérine, initiant sa phosphorylation par Src42A puis l’activation de la voie de transduction menant à l’expression du gène cible de béta-caténine twist responsable de l'induction de l'endomesoderme
Les simulations prédisent en effet que sous l’effet d’une force de 6pN, les deux alpha-hélices connectées par l’interaction Y654-b-cat et D665-Ecad se dilatent de 1nm, et que le site Y654 a 15% de chance de s’ouvrir (Fig.2a). Une telle dilatation été confirmée quantitativement expérimentalement en FLIM en réponse à l’invagination du mésoderme (non montré) ou aux contraintes mécaniques associées, mimées par voie magnétique dans des embryons défectifs en gastrulation (Fig. 2b). Le site Y654 se trouve alors en effet rendu plus accessible à son anticorps spécifique sous contrainte, de l’ordre de 20% (Fig. 2c) – et ce encore plus, de façon cohérente, en absence de Src42A responsable de sa phosphorylation sous contrainte mécanique et de son relargage dans le cytosol pour transcription. Ceci favorise son relargage des jonctions (non montré) (Röper et al, e-Life 2018), et stimule le maintien de l’expression du gène twist au cours de l’invagination du mésoderme (voir partie « Evo-Devo » et « Biologie du Développement » ci-dessous, Desprat et al, Dev. Cell. 2008, Brunet, Bouclet et al, Nature Communications 2013).
Les contraintes mécaniques développées par la croissance tumorale induisent l'induction de l'expression de gènes tumoraux via l'activation mécanique de la phosphorylation du site Y654 de la béta-caténine in vivo.
Nous avons trouvé l’induction mécanique de l’activation de la β-caténine et de l’expression des oncogènes sous contrôle, dans l'hyperolifération cellulaire dans le colon normal de souris, et dans l’initiation de la tumorigenèse dans le colon pré-tumoral (i.e en présence d'une mutation hétérozygote pour Apc, les mutations Apc étant trouvées dans 85% des cancers du colon humain) en réponse à la pression de croissance tumorale in vivo (M-E Fernandez-Sanchez, S. Barbier et al, Nature 2015, – Figure 3 ).
Pour ce faire, nous avons mimé la pression de croissance tumorale de 1kPa en incluant des liposomes ultra-magnétiques dans les cellules mésenchémiales du tissu conjonctif des cryptes du colon, auxquels nous avons appliqué un gradient de champ magnétique par insertion d’un aimant cylindrique millimétrique en sous-cutané face au colon. Cette contrainte a mené à l’activation de la phosphorylation du site Y654 d’un pool de béta-caténine inducteur de son relargage des jonctions vers le cytoplasme. Elle a de plus mené à la phosphorylation du site Ser9 de la GSK3β permettant la translocation de la beta-caténine cytoplasmique dans le noyau, puis à l’expression des gènes cibles tumoraux tels que c-Myc. Le même résultat a été observé dans les cellules des cryptes non tumorales comprimées par les cryptes tumorales hyper-prolifératives (exprimant Notch), dans un modèle de souris récapitulant le processus de progression tumorale.
Dans ce cadre tumoral, nous avons trouvé que la kinase qui phosphoryle Y654-βcat est Ret. Nous avons trouvé que Ret est de plus elle-même activée (phosphorylée sur son site Y1032) mécaniquement, et se trouve à la fois en amont de la phosphorylation de Y654-βcat et de l’inactivation de GSK3-β par sa phosphorylation sur Ser9 (M-E Fernandez-Sanchez, S. Barbier et al, Nature 2015).
Les pulsations myogéniques spontanées du colon maintiennent le niveau physiologique de Cellules Souches via l’activation mécanique de la voie Ret/β-cat, un processus amplifié de façon pathologique par la pression de croissance tumorale s’y ajoutant en présence de tumeurs.
Le blocage des pulsations myogéniques spontanées de 1kPa d’amplitude par un cannabinoïde (Win) montre in vivo la diminution d’un facteur 2 du nombre de cellules souches, que l’on trouve rétabli par l’application d’une pression magnétique pulsée de la même amplitude, à l’aide de technologies magnétiques analogues à celles développées pour produire la pression de croissance tumorale in vivo (voir Figure 3). Ce rétablissement est bloqué par l’utilisation d’inhibiteurs de Ret ( Figure 3-iiA, Nguyen Ho-Bouldoires, Sollier, Zamvirof et al Comm Biol 2022).
Dans les souris normales, ajouter par voie magnétique la pression de croissance tumorale de 1kPa augmente cette fois d’un facteur 1.5 le nombre de Cellules Souches, ainsi que d’un facteur 2 dans le contexte muté pour Apc (voir paragraphe ci-dessus). Cette augmentation est à l’origine de l’induction mécanique de la tumorigenèse et de l’hyperprolifération associée Figure 3-iiB UML Magnet 1m). Elle est bloquée par l’inhibiteur de Ret Vandetanib ( Figure 3-iiB UML Magnet 1m Vande) (Nguyen Ho-Bouldoires, Sollier, Zamvirof et al Comm Biol 2022).

Figure 3-iii Stimulation mécanique de l'activation de Ret et de formation de cellules souches (expression de Lgr5) par voie acoustique.
Plus récemment, l'utilisation d'ondes ultrasonores focalisées (FUS) nous a permis d'observer de même la stimulation mécanique de l'activation de Ret, et de la formation de cellules souches (Figure 3-iii, Zamvirof, Nguyen et al, Nat. Biomed. Eng., 2024).
Evo-Devo : une origine évolutive mécano-transductionelle à l’émergence du mésoderme dans le dernier ancêtre commun des animaux complexes, les bilatériens.
Nous avons trouvé que l’activation mécanique de la voie béta-caténine, induite de façon anormale dans le processus de développement tumoral, est une propriété ancestrale, probablement à l’origine de l’émergence de patterns de différentiation embryonnaires chez les organismes anciens, tels que l’émergence du mésoderme chez le dernier ancêtre commun des bilatériens. Nous avons en effet trouvé la conservation de l’induction mécanique de l’expression des gènes de différentiation précoce du mésoderme par le tout premier mouvement morphogénétique de l’embryogenèse, dans le poisson zèbre (vertébré) et dans la Drosophile (arthropode). Cette induction mécanique est initiée par l’activation mécanique de la phosphorylation du site Y654 de la béta-caténine inhibant son interaction avec la E-cadhérine, menant à son relargage dans le cytoplasme et le noyau, puis à l’expression des gènes cibles brackury and twist, premiers gènes de différentiation précoce du mésoderme (Figure 4).
Or, l’origine évolutive de l’émergence du mésoderme reste aujourd’hui une question ouverte importante de l’Evo-Devo. Nos résultats suggèrent que la phosphorylation du site Y654 de la béta-catenine en réponse au tout premier mouvement morphogénétique de l’embryogenèse soit à l’origine de l’émergence du mésoderme dans l’ancêtre commun des bilatériens, in y a 570 millions d’années (Brunet, Bouclet et al, Nature Communications 2013).
Evo-Devo : une origine mécano-transductionelle plus ancienne de la spécification et de la morphogenèse de l'endo-mésoderme chez les premiers métazoaires par les contraintes mécaniques environnementales hydrodynamiques marines
Plus récemment, nous avons découvert l'induction mécanotransductive de l’expression du gène endo-mésodermal fz10 via l'activation mécanique de la phosphorylation Y654 par le mouvement morphogénétique de la gastrulation chez le cnidaire anémone de mer Nematostella vectensis (N. vectensis) (Fig.4-iiA), dont l'ancêtre commun avec les bilateriens remonte à 600-700 millions d'années. On pense que la différentiation de l'endo-mésoderme, ancestral à la différenciation de l'endoderme et du mésoderme, a probablement spécifié les tissus intestinaux primitifs des premiers Métazoaires, il y a plus de 700 millions d'années.
Nous avons également constaté que les contraintes mécaniques développées par les flux hydrodynamiques marins déclenchent la gastrulation dans les embryons précoces de N. vectensis selon un processus dépendant de Myo-II (Fig.4-iiB), ce qui rappelle la stimulation mécanique de l'invagination du mésoderme trouvée dans les embryons bilatériens de drosophiles (Fig.1). De plus, nous avons trouvé une stimulation hydrodynamique dépendante de Myo-II de l'inversion de type gastrulation de Choanoeca flexa (Fig.4-iiC), un groupe soeur des Metazoa dont l'ancêtre commun date de plus de 700 millions d'années.

Figure 4-iii: Conservation de la stimulation hydrodynamique Myo-II-dépendante de l'inversion, similaire à la gastrulation, dans le dernier ancêtre commun des organismes pluricellulaires pré-métazoaires datant d'au moins 700 millions d'années.
Nos résultats indiquent que l'émergence de la formation de l'endo-mésoderme chez les premiers métazoaires a pu être stimulée de manière mécanotransductive par des contraintes mécaniques marines hydrodynamiques environnementales, conduisant à sa gastrulation, puis à sa spécification par la gastrulation, chez les premiers métazoaires (Figure 4-iii, M.N. Nguyen, T. Merle et al., Front. Dev. Cell Biol. 2022, Nguyen and Farge, Nat. Com., 2024).
Biologie du développement: couplage mécano-génétique et mécano-protéique réciproque dans la régulation du développement embryonnaire à la gastrulation.
Le développement embryonnaire consiste en la coordination de processus multi-cellulaires de différentiation cellulaire, et de morphogenèse biomécanique. Ces dernières décennies, le rôle du moteur moléculaire Myosine-II dans l’activation des processus de morphogenèse biomécanique a été caractérisé comme étroitement régulé par l’expression des gènes du développement de différentiation.
Nous avons révélé l’existence d’une régulation inverse, de l’activation de l’expression du gène de différentiation Twist (Figure 5) et de la relocalisation active de la Myosin-II (Figure 5), par les contraintes mécaniques développées par les mouvements morphogénétiques de la gastrulation. Cette régulation est générée par les processus de mécano-transduction impliquant l’activation mécanique de la beta-caténine et de la voie de signalisation Fog (associé à l’inhibition mécanique de l’endocytose de Fog, voir paragraphe suivant), respectivement.
Nous avons utilisé les outils expérimentaux (outils biophysiques et génétiques de modulation des mouvements morphogénétiques) (Figure 5,6), comme les outils théoriques (simulations intégrant les connaissance génétiques de la régulation de la morphogenèse) (Figure 7), pour découpler les paramètres de contrôle génétiques et mécaniques, dans la régulation de l’expression de Twist et de la localisation active de la Myosine-II. En particulier, nous avons mis en place une méthode de pinces magnétiques pour évaluer et contrôler les forces physiologiques impliquées dans la morphogenèse, afin de mimer les mouvements morphogénétiques endogènes de l’embryogenèse de l’intérieur du tissu embryonnaire vivant (Figure 5). Farge, Curr. Biol., 2003; Desprat et al, Dev. Cell. 2008; Pouille et al Phys. Biol. 2008; Ahmadi, Pouille et al, Science Signalling, 2009.
Endocytose: force motrice de l’endocytose et modulation mécanique de l’endocytose comme processus mécanotransductionnel de transdifférentiation cellulaire.
Historiquement, la première thématique étudiée dans le groupe a été celle des propriétés motrices des membranes biologiques relevant de la physique de la matière molle dans la vésicularisation des membranes initiant le processus d’endocytose de la membrane plasmique (Rauch et al, Bioph. J, 2000), ainsi que le rôle de l’inhibition mécaniquement induite de l’endocytose de signaux morphogènes dans l’induction mécanique de la trans-différentiation cellulaire (Figure 8, Rauch et al, Am. J. Cell Phys, 2002)