- Accueil >
- Les actualités de l'Institut Curie >
- Cancer du sein triple négatif : de nouvelles données dans la régulation de la voie mTOR
Parmi les traitements proposés aux patientes atteintes de cancers du sein triple négatif, certaines molécules visent une voie cellulaire spécifique, hyperactivée dans ces tumeurs. Une étude menée par le Dr Philippe Chavrier, directeur de recherche au CNRS et chef d’équipe (CNRS UMR144 / Sorbonne université) à l’Institut Curie, et publiée dans Developmental Cell le 26 décembre 2024 montrent que le blocage pharmacologique de cette voie cellulaire accroît la dégradation de la matrice extracellulaire, et pourrait favoriser le comportement invasif des cellules.
Les cancers du sein triple négatif, qui comptent pour 15 % des cancers du sein (source INCa 2023), touchent particulièrement les femmes jeunes et restent difficiles à traiter. Le développement de thérapies efficaces et novatrices contre ce cancer est indispensable pour soigner les patientes qui en sont atteintes. L’Institut Curie, à travers son Institut hospitalo-universitaire (IHU) Institut des Cancers des Femmes en a fait une de ces thématiques centrales de recherche.
Dans une large fraction de cancers, une voie cellulaire, nommée PI3K/AKT/mTOR, est hyperactivée. Une ligne thérapeutique proposée aux patientes consiste à inhiber l’activité du complexe protéique mTOR, bloquant ainsi la cascade de réactions à l’origine de la prolifération tumorale. La voie PI3K/AKT/mTOR est fréquemment hyperactivée dans les cancers du sein triple négatif et des essais cliniques en cours ciblent cette voie.
En utilisant des modèles pertinents cliniquement de cancers du sein triple négatif, des travaux publiés sur le site de Developmental Cell et menés par le Dr Philippe Chavrier, chef de l’équipe Dynamique de la membrane et du cytosquelette (CNRS UMR144 / Sorbonne Université) à l’Institut Curie ont mis en évidence que l’inhibition de mTOR pouvait induire la dégradation de la matrice extracellulaire, notamment par la formation d’invadopodes. Ces structures cellulaires spécialisées des cellules tumorales leurs permettent d’envahir les tissus. Les invadopodes facilitent donc l’invasion tumorale et augmentent le risque de métastases.
En remontant la chaîne de réactions de la voie PI3K/AKT/mTOR, les auteurs ont également observé que la répression de mTOR stimulait la surexpression du facteur de transcription TFEB, lui aussi impliqué dans la formation des invadopodes. « Les études sur le cancer du sein triple négatif montrent quecibler mTOR réduit la prolifération cellulaire. Nos travaux soulèvent plusieurs questions et notamment, celle du risque de rendre les tumeurs plus invasives,» continue Philippe Chavrier.
Par ailleurs, des résultats précédents de la même équipe, publié dans Advanced Sciences, 2021, démontraient qu’une carence des cellules en nutriments favorisait la répression de mTOR et activait la dégradation de la matrice extracellulaire. « Nos résultats suggèrent que bloquer mTOR pourrait renforcer les capacités des cellules tumorales à se déplacer. Il est donc nécessaire de multiplier les recherches sur ce sujet, afin de comprendre les réelles implications cliniques des inhibiteurs de mTOR dans le traitement des cancers du sein triple négatif, » conclut Philippe Chavrier.
Ces recherches ont été rendues possibles grâce au don exceptionnel d’un million d’euros de Trond S. Paulsen pour la lutte contre l’invasion tumorale (programme InvaCell en collaboration avec le radium Hospital et l’Université d’Oslo), et grâce au soutien de l’Association Ruban Rose et de la Fondation ARC.

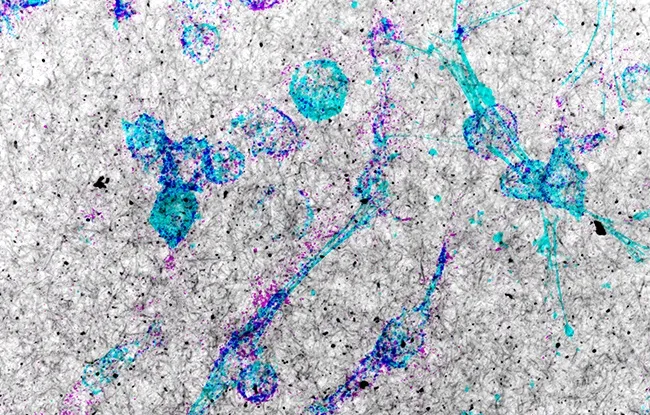
Figure : L’image montre des cellules cancéreuses provenant d’une tumeur de patiente atteinte d’un cancer du sein triple-négatif. Les cellules (cyan) ont été traitées par un inhibiteur de la voie mTOR (Torin-1) et incubées dans une matrice constituée de filaments de collagène de type I (noir et blanc). La dégradation de la matrice de collagène fortement augmentée par le traitement par Torin-1 est révélée par un marquage visible en magenta.
Référence :
David Remy, Sandra Antoine-Bally, Sophie de Toqueville, Célia Jolly, AnneSophie Macé, Gabriel Champenois, Fariba Nemati, Isabel Brito, Virginie Raynal, Amulya Priya, Adèle Berlioz, Ahmed Dahmani, André Nicolas, Didier Meseure, Elisabetta Marangoni, and Philippe Chavrier. TFEB triggers a matrix degradation and invasion program in triple-negative breast cancer cells upon mTORC1 repression. Developmental Cell. 26 décembre 2024.