Présentation
Notre recherche se concentre principalement sur l’étude des populations de cellules vivantes en interaction à l’aide de concepts et de techniques de physique.
Nous menons des projets expérimentaux portant sur différents aspects de la communication entre les cellules dans différents systèmes (incluant les bactéries et les cellules de mammifères). Pour obtenir une bonne maîtrise spatiale et temporelle du micro-environnement cellulaire, nous utilisons largement les possibilités offertes par les techniques de microfabrication/microfluidique. Nous développons également des outils d’analyse quantitative de nos données expérimentales, ce qui permet d’interpréter les comportements des populations sur la base de celui des cellules individuelles. Les résultats obtenus grâce à cette approche ont conduit à plusieurs collaborations avec des groupes théoriques et des groupes de biologie en France et à l’étranger.
Chimiotactisme collectif des bactéries (A. Buguin)
Les bactéries chimiotactiques E. coli qui nagent en suspension dans un milieu liquide consomment les nutriments présents dans la solution et communiquent entre elles par l’intermédiaire de facteurs solubles. Ces propriétés donnent lieu à des comportements complexes (formation de motifs, fluctuations spontanées de concentration…). Ce système peut être étudié dans des canaux microfluidiques. Lorsque leur concentration est suffisamment importante, les bactéries forment alors des ondes qui se propagent d’une extrémité à l’autre du canal. Nous mesurons quantitativement la propagation de ces pulses de concentration (figure 1) pour différentes géométries des canaux et nous interprétons ces résultats dans le cadre d’un modèle cinétique. Nos projets visent à perturber ces impulsions par l’application d’un champ externe sur les cellules, ou à étudier l’interaction de mélanges de plusieurs souches ayant des comportements différents séparément.
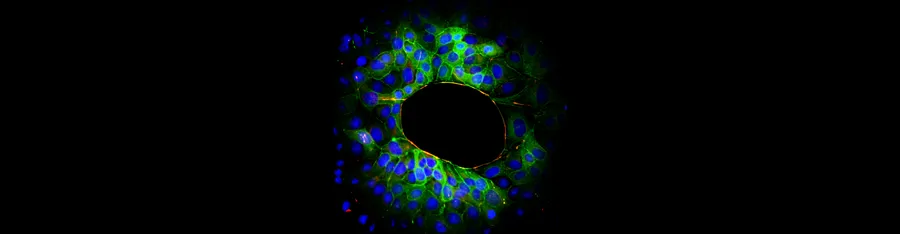
Migration collective de cellules épithéliales (P. Silberzan).
Lorsqu’elles font face à une surface libre, les cellules épithéliales d’une monocouche migrent collectivement sur le substrat disponible tout en maintenant des contacts cellule-cellule (figure 2). Pour les cellules adhérant à leur substrat, c’est l’activité des protrusions qui contrôle cette migration jusqu’aux très petites tailles de blessure. En revanche, sur un substrat non adhésif, les blessures se ferment par un mécanisme de cordon de bourse via la contraction du câble d’actomyosine périphérique. La migration collective implique généralement des doigts de migration entraînés par les cellules leaders qui se développent au bord libre. Ces doigts composés de jusqu’à 100 cellules, se comportent comme des « super-cellules » mécaniquement cohérents et reproduisent à l’échelle multicellulaire le dipôle de forces développé par des cellules uniques en migration. La migration collective des cellules est bien décrite par un modèle de particules en interaction dans lequel les cellules ont tendance à adapter leur mouvement à celui de leurs voisines. Le même modèle décrit aussi quantitativement les oscillations observées dans des épithéliums confluents confinés. A très haute densité, les mouvements des cellules se gèlent progressivement alors que se développent des structures multicellulaires tridimensionnelles.
Nématiques cellulaires (P. Silberzan)
Les cellules confluentes fusiformes (comme les fibroblastes ou les myoblastes) forment des monocouches présentant des domaines d’orientation uniforme séparés par des défauts topologiques caractéristiques des phases nématiques (Fig. 3). Des fibroblastes confinés dans des bandes de largeur mésoscopique s’alignent parfaitement avec la bande et expulsent les défauts. En revanche, lorsque les cellules sont confinées dans des disques, elles s’organisent autour d’une paire de défauts dont les positions sont caractéristiques d’un système dominé par la friction cellule-substrat. Les myoblastes cultivées dans des bandes similaires développent une instabilité au-dessus d’une largeur critique : le tissu est alors caractérisé par l’apparition d’une inclinaison chirale des cellules par rapport à la direction de la bande, ainsi que par un cisaillement spontané de l’écoulement des cellules aux bords. Ces résultats sont bien expliqués par les théories de gels actifs développées au laboratoire. Nous nous penchons maintenant sur l’importance de cette contribution aux cocultures de cellules épithéliales et nématiques.
Compétition cellulaire (I. Bonnet)
La compétition cellulaire est un processus fondamental par lequel les interactions entre deux types de cellules contrôlent l’élimination de l’un d’entre eux. Jusqu’à présent, les travaux expérimentaux ont surtout porté sur le comportement de cellules individuelles transformées dans des monocouches normales. Nous avons récemment lancé un projet visant à étudier le comportement d’un ensemble de cellules transformées par l’oncogène Src dans une monocouche normale. Pour ce faire, nous utilisons un dispositif basé sur l’optogénétique, dans lequel un îlot de cellules de forme et de taille données peut être transformé à volonté sous le microscope par une exposition sélective à la lumière, à une longueur d’onde spécifique. Les premiers résultats montrent une extrusion collective massive des cellules Src.
Monocouches cellulaires dans des environnements topologiques complexes (S. Coscoy)
Dans de multiples situations physiologiques, les cellules épithéliales en monocouches explorent la troisième dimension en repliant cette monocouche dans l’espace, pour former par exemple des tubules ou des kystes. Nous avons récemment étudié l’impact de la courbure hors-du-plan sur les cellules épithéliales en les cultivant sur des fibres de verre de rayons bien définis. La géométrie inverse (croissance des cellules dans des tubes) est plus pertinente pour étudier le mécanisme de formation des kystes rénaux qui caractérisent des situations pathologiques. Nous avons conçu et mis au point un dispositif microfluidique permettant aux cellules de coloniser des canaux cylindriques ménagés dans des hydrogels (figure 5). Ce système modèle prometteur permet d’imiter la géométrie et les propriétés mécaniques des tubules rénaux.
- Voir l’exposé de Pascal au cours international Curie « Intégration multi-échelle des systèmes biologiques » (2014): Collective cell migration
- Voir l'exposé de Pascal à Cambridge (2023): Emergence of flows and tridimensional structures in active cell monolayers



























