Présentation

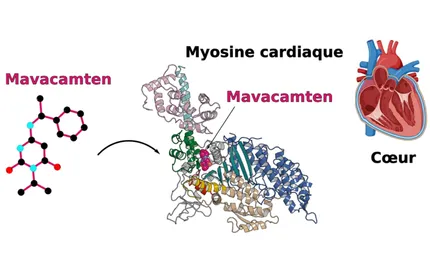
Les mouvements coordonnés au cœur de la vie des tissus biologiques sont impressionnants dans leur complexité et leur précision. Dans chaque cellule, des nano-moteurs moléculaires (un millionième de fois plus petits que le millimètre) contribuent à ces mouvements en effectuant de nombreuses actions mécaniques avec précision et une orchestration complexe. Les multiples fonctions qu’une cellule eucaryote accomplit dépendent de la motilité (capacité à se mouvoir ou à exercer une force), qui est nécessaire à l’échelle moléculaire, comme cellulaire. Notre objectif est d'étudier les principes qui sous-tendent la conversion de l'énergie chimique en mouvement mécanique par ces nanomoteurs et de comprendre comment ces protéines motrices ont évolué pour permettre des fonctions cellulaires distinctes, activée avec précision dans l'espace et le temps. Cibler ces nanomoteurs peut être bénéfique pour la santé humaine. Des sites allostériques pour des candidats médicaments peuvent agir comme activateurs ou inhibiteurs de la force produite par ces nanomoteurs. Nous étudions des médicaments qualifiés de thérapie de pointe par la FDA, actuellement en essais cliniques de phase 3 contre des cardiomyopathies. Alors que des sites fréquents de mutations dans ces moteurs peuvent conduire à des phénotypes pathologiques, un potentiel thérapeutique élevé des effecteurs allostériques est maintenant établi et nous visons à étendre ces connaissances pour traiter d'autres pathologies comme le cancer et la malaria.
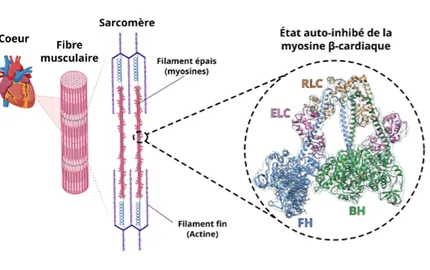
L’équipe Motilité Structurale étudie le mécanisme d’action des nanomoteurs du cytosquelette, combinant des techniques de biologie structurale, des essais fonctionnels et cellulaires, afin de comprendre leurs rôles dans la cellule. Notre objectif est d’étudier comment l’interaction de chaque nanomoteur avec les filaments d’actine permet de convertir l’énergie chimique (fournie par la fixation et l’hydrolyse de l’ATP) en énergie mécanique, ce qui leur permet d’effectuer une grande variété de fonctions cellulaires. Notre laboratoire a également acquis des compétences en cryo-microscopie électronique (cryo-EM) et en dynamique moléculaire. Ces deux techniques permettent de compléter les données obtenues à partir des structures cristallographiques à haute-résolution et d’étudier le moteur dans différents états conformationnels. Enfin, nous étudions également de petites molécules capables de moduler spécifiquement la force produite par les myosines, certains de ces composés sont déjà en test clinique afin de fournir de nouvelles générations de médicaments contre des pathologies comme l’asthme ou les cardiomyopathies.
- Changements conformationnels allostériques chez la myosine et mécanisme de génération de force
- Blanc, F., Isabet, T., Benisty, H., Sweeney, H.L., Cecchini, M., Houdusse, A., 2018. An intermediate along the recovery stroke of myosin VI revealed by X-ray crystallography and molecular dynamics. Proc. Natl. Acad. Sci. 115, 6213–6218. https://doi.org/10.1073/pnas.1711512115
- Robert-Paganin, J., Robblee, J.P., Auguin, D., Blake, T.C.A., Bookwalter, C.S., Krementsova, E.B., Moussaoui, D., Previs, M.J., Jousset, G., Baum, J., Trybus, K.M., Houdusse, A., 2019. Plasmodium myosin A drives parasite invasion by an atypical force generating mechanism. Nat. Commun. 10, 3286. https://doi.org/10.1038/s41467-019-11120-0
- Robert-Paganin, J., Pylypenko, O., Kikuti, C., Sweeney, H.L., Houdusse, A., 2020. Force Generation by Myosin Motors: A Structural Perspective. Chem. Rev. 120, 5–35. https://doi.org/10.1021/acs.chemrev.9b00264
- Robert-Paganin, J., Xu, X.-P., Swift, M.F., Auguin, D., Robblee, J.P., Lu, H., Fagnant, P.M., Krementsova, E.B., Trybus, K.M., Houdusse, A., Volkmann, N., Hanein, D., 2021. The actomyosin interface contains an evolutionary conserved core and an ancillary interface involved in specificity. Nat. Commun. 12, 1892. https://doi.org/10.1038/s41467-021-22093-4
- Pospich, S., Sweeney, H.L., Houdusse, A., Raunser, S., 2021. High-resolution structures of the actomyosin-V complex in three nucleotide states provide insights into the force generation mechanism. eLife 10, e73724. https://doi.org/10.7554/eLife.73724
- Grinzato, A., Auguin, D., Kikuti, C., Nandwani, N., Moussaoui, D., Pathak, D., Kandiah, E., Ruppel, K.M., Spudich, J.A., Houdusse, A., Robert-Paganin, J., 2023. Cryo-EM structure of the folded-back state of human β-cardiac myosin. Nat. Commun. 14, 3166. https://doi.org/10.1038/s41467-023-38698-w
Impact de mutations sur la régulation et la fonction du moteur, étude du mode d’action de petites molécules modulant la force générée afin de développer de nouvelles thérapies
Planelles-Herrero, V.J., Hartman, J.J., Robert-Paganin, J., Malik, F.I., Houdusse, A., 2017. Mechanistic and structural basis for activation of cardiac myosin force production by omecamtiv mecarbil. Nat. Commun. 8, 190. https://doi.org/10.1038/s41467-017-00176-5
Robert-Paganin, J., Auguin, D., Houdusse, A., 2018. Hypertrophic cardiomyopathy disease results from disparate impairments of cardiac myosin function and auto-inhibition. Nat. Commun. 9, 4019. https://doi.org/10.1038/s41467-018-06191-4
Moussaoui, D., Robblee, J.P., Robert-Paganin, J., Auguin, D., Fisher, F., Fagnant, P.M., Macfarlane, J.E., Schaletzky, J., Wehri, E., Mueller-Dieckmann, C., Baum, J., Trybus, K.M., Houdusse, A., 2023. Mechanism of small molecule inhibition of Plasmodium falciparum myosin A informs antimalarial drug design. Nat. Commun. 14, 3463. https://doi.org/10.1038/s41467-023-38976-7
Gyimesi, M., Horváth, Á.I., Túrós, D., Suthar, S.K., Pénzes, M., Kurdi, C., Canon, L., Kikuti, C., Ruppel, K.M., Trivedi, D.V., Spudich, J.A., Lőrincz, I., Rauscher, A.Á., Kovács, M., Pál, E., Komoly, S., Houdusse, A., Málnási-Csizmadia, A., 2020. Single Residue Variation in Skeletal Muscle Myosin Enables Direct and Selective Drug Targeting for Spasticity and Muscle Stiffness. Cell 183, 335-346.e13. https://doi.org/10.1016/j.cell.2020.08.050
Hartman, J.J., Hwee, D.T., Robert-Paganin, J., Chuang, C., Chin, E.R., Edell, S., Lee, K.H., Madhvani, R., Paliwal, P., Pernier, J., Sarkar, S.S., Schaletzky, J., Schauer, K., Taheri, K.D., Wang, J., Wehri, E., Wu, Y., Houdusse, A., Morgan, B.P., Malik, F.I., 2024. Aficamten is a small-molecule cardiac myosin inhibitor designed to treat hypertrophic cardiomyopathy. Nat. Cardiovasc. Res. 3, 1003–1016. https://doi.org/10.1038/s44161-024-00505-0
Auguin, D., Robert-Paganin, J., Réty, S., Kikuti, C., David, A., Theumer, G., Schmidt, A.W., Knölker, H.-J., Houdusse, A., 2024. Omecamtiv mecarbil and Mavacamten target the same myosin pocket despite opposite effects in heart contraction. Nat. Commun. 15, 4885. https://doi.org/10.1038/s41467-024-47587-9
Radnai, L., Young, E.J., Kikuti, C., Toth, K., Zhou, M., Hafenbreidel, M., Stremel, R.F., Lin, L., Pasetto, P., Jin, X., Patel, A., Conlon, M., Briggs, S.B., Heidsieck, L., Sweeney, H.L., Sellers, J., Krieger-Burke, T., Martin, W.H., Sisco, J., Young, S., Pearson, P., Rumbaugh, G., Araldi, G.L., Duddy, S.K., Cameron, M.D., Surman, M., Houdusse, A., Griffin, P.R., Kamenecka, T.M., Miller, C.A., 2025. Development of clinically viable non-muscle myosin II small molecule inhibitors. Cell 188, 4604-4621.e15. https://doi.org/10.1016/j.cell.2025.06.006
- Comment les myosines s’adaptent à leurs rôles cellulaires spécifiques, en utilisant la force générée à des fins différentes ?
- Ropars, V., Yang, Z., Isabet, T., Blanc, F., Zhou, K., Lin, T., Liu, X., Hissier, P., Samazan, F., Amigues, B., Yang, E.D., Park, H., Pylypenko, O., Cecchini, M., Sindelar, C.V., Sweeney, H.L., Houdusse, A., 2016. The myosin X motor is optimized for movement on actin bundles. Nat. Commun. 7, 12456. https://doi.org/10.1038/ncomms12456
- Pylypenko, O., Welz, T., Tittel, J., Kollmar, M., Chardon, F., Malherbe, G., Weiss, S., Michel, C.I.L., Samol-Wolf, A., Grasskamp, A.T., Hume, A., Goud, B., Baron, B., England, P., Titus, M.A., Schwille, P., Weidemann, T., Houdusse, A., Kerkhoff, E., 2016. Coordinated recruitment of Spir actin nucleators and myosin V motors to Rab11 vesicle membranes. eLife 5, e17523. https://doi.org/10.7554/eLife.17523
- Yu, I.-M., Planelles-Herrero, V.J., Sourigues, Y., Moussaoui, D., Sirkia, H., Kikuti, C., Stroebel, D., Titus, M.A., Houdusse, A., 2017. Myosin 7 and its adaptors link cadherins to actin. Nat. Commun. 8, 15864. https://doi.org/10.1038/ncomms15864
- Arthur, A.L., Songster, L.D., Sirkia, H., Bhattacharya, A., Kikuti, C., Borrega, F.P., Houdusse, A., Titus, M.A., 2019. Optimized filopodia formation requires myosin tail domain cooperation. Proc. Natl. Acad. Sci. 116, 22196–22204. https://doi.org/10.1073/pnas.1901527116
- Houdusse, A., Titus, M.A., 2021. The many roles of myosins in filopodia, microvilli and stereocilia. Curr. Biol. CB 31, R586–R602. https://doi.org/10.1016/j.cub.2021.04.005
- Canon, L., Kikuti, C., Planelles-Herrero, V.J., Lin, T., Mayeux, F., Sirkia, H., Lee, Y.I., Heidsieck, L., Velikovsky, L., David, A., Liu, X., Moussaoui, D., Forest, E., Höök, P., Petersen, K.J., Morgan, T.E., Di Cicco, A., Sirés-Campos, J., Derivery, E., Lévy, D., Delevoye, C., Sweeney, H.L., Houdusse, A., 2023. How myosin VI traps its off-state, is activated and dimerizes. Nat. Commun. 14, 6732. https://doi.org/10.1038/s41467-023-42376-2