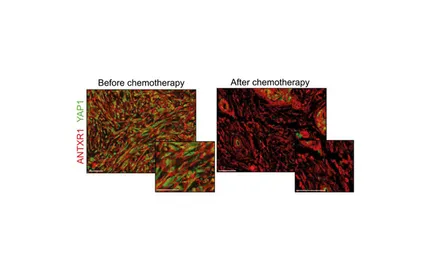
Présentation

Les tumeurs sont des écosystèmes cellulaires complexes composés par les cellules tumorales et les cellules du microenvironnement tumoral. Le microenvironnement tumoral inclut notamment les cellules immunitaires de défense de l’organisme, les cellules endothéliales et péricytaires constituant les vaisseaux sanguins et lymphatiques, ainsi que les fibroblastes composant le tissu de soutien. La caractérisation précise de ces différentes composantes des tumeurs au moment du diagnostic et leur évolution au cours du traitement est un enjeu thérapeutique majeur pour lutter contre les cancers métastatiques et les cancers résistants au traitement à l’origine de la plupart des décès de patients. En effet, les cellules tumorales ne peuvent à elles seules expliquer les mécanismes de développement tumoral, de progression cancéreuse et de résistance au traitement. Il est important de considérer les tumeurs dans leur globalité, et ainsi l’ensemble des populations cellulaires présentes dans le microenvironnement tumoral.

Le laboratoire « Stress et Cancer » investigue l’hétérogénéité et la plasticité des cancers, en considérant les tumeurs dans leur globalité, c’est-à-dire en analysant non seulement les cellules tumorales mais aussi les cellules du micro-environnement tumoral. Nous nous intéressons particulièrement aux liens existants entre les cellules cancéreuses et le micro-environnement tumoral, et leur implication dans la propagation métastatique, la récidive et la résistance aux traitements. Pour cela, nos interactions étroites avec des médecins de l’Institut Curie, notamment le Dr. A. Vincent-Salomon, nous permettent d’analyser en détail les échantillons de patients grâce à des techniques innovantes, notamment des études sur cellules uniques, de transcriptomiques spatiales, des immuno-marquages multiplexés et des tumeur-sur-puces. Nos études reposent également sur le développement d’outils bioinformatiques et de modélisations mathématiques permettant l’extraction, l’analyse et l’intégration des données nécessaires à la caractérisation profonde des tumeurs des patients.
Grâce à ces projets interdisciplinaires, nous souhaitons rendre compte de l’importance de l’hétérogénéité cellulaire dans la progression cancéreuse selon différents axes d’études qui visent à :
- Axe 1 : Définir l’impact de l’hétérogénéité et la plasticité du microenvironnement tumoral dans différents types de cancer, dont les cancers du sein, de l’ovaire et du poumon. Nous étudions plus particulièrement différentes populations de fibroblastes associés au cancer (CAF), populations que nous avons découvertes et qui ne sont pas encore ciblées par des traitements, offrant ainsi une opportunité thérapeutique majeure.
- Axe 2 : Caractériser la diversité des cellules tumorales dans les cancers à travers le métabolisme cellulaire et l’activation de voies de signalisations spécifiques ainsi que leur rôle dans la réponse aux traitements.
- Axe 3 : Développer des systèmes de modélisation tumorale ex-vivo afin de reproduire la complexité des tumeurs et étudier de manière intégrative les interactions cellulaires et les mécanismes de résistance aux traitements.
Notre équipe de recherche, portée par le Dr Fatima Mechta-Grigoriou, est pluridisciplinaire, comprenant des biologistes, des cliniciens et des bio-informaticiens. Nous travaillons également en collaboration avec des physiciens. Renforcée par de nombreuses collaborations avec d’autres équipes de l’Institut Curie et d’ailleurs, nous intégrons à nos études d’autres spécialités telles que les mathématiques et l’intelligence artificielle afin d’aller plus loin dans nos recherches et proposer de nouvelles pistes diagnostiques et thérapeutiques dont pourraient bénéficier les patients atteints de cancer.