- Accueil >
- Les actualités de l'Institut Curie >
- Des molécules d’un genre nouveau pour détruire les cellules cancéreuses du pancréas
Inactives lorsqu’elles sont administrées, les « prodrogues » deviennent bio-actives à la suite d’une réaction chimique à l’intérieur de la cellule ou de l’organisme. Publiés dans le Journal of the American Chemical Society, ces résultats mettent à profit la chimie du fer dans le cancer et ouvrent la voie au développement d’une nouvelle classe de médicaments anti-tumoraux.
Le cancer du pancréas compte parmi les tumeurs dont le pronostic est sombre et pour lequel le besoin de nouvelles options thérapeutiques est crucial. Ainsi, l’équipe de Raphaël Rodriguez, directeur de recherche au CNRS au sein de l’unité Chimie et Biologie de la Cellule (Institut Curie, Inserm, CNRS) décortique la chimie du fer en jeu dans les processus tumoraux et métastatiques pour découvrir de nouvelles cibles et pistes thérapeutiques. Les chercheurs ont mené une étude spécifique sur des cellules issues de tumeurs pancréatiques. Décryptage.
Elimination par ferroptose des cellules tumorales du pancréas
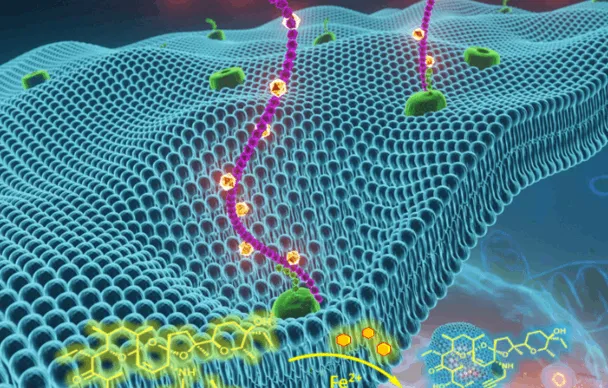
Le fer est impliqué dans des mécanismes cellulaires qui conduisent certaines cellules – dites persistantes - à devenir métastatiques, résistantes aux traitements anti-tumoraux conventionnels et donc à l’origine des récidives. Cependant, du fait même de la présence du fer, ces mêmes cellules présentent une sensibilité accrue à la ferroptose : une mort cellulaire provoquée par la formation incontrôlée de certains composés létaux (lipides peroxydés) qui se forme dans un compartiment spécifique de la cellule (le lysosome). C’est sur cette sensibilité que s’appuient les chercheurs pour mettre en œuvre une stratégie ciblant spécifiquement cette voie chimique.
Dans cette étude, nous démontrons une nouvelle fois que les voies chimiques sont un levier thérapeutique puissant pour amplifier certains phénomènes qui conduisent à la mort des cellules cancéreuses, en l’occurrence ici des cellules du pancréas
Se réjouit Raphaël Rodriguez.
Grâce aux petites molécules chimériques que nous avons développées, notre fenêtre thérapeutique s’élargit : nous parvenons à cibler spécifiquement les cellules tumorales les plus néfastes pour l’organisme tout en épargnant les cellules saines. S’il nous faut poursuivre nos travaux vers la clinique, les perspectives sont prometteuses.
Une toute nouvelle classe de « pro-drogues » anti-cancéreuses
L’équipe de Raphaël Rodriguez est donc parvenue à synthétiser une série de petites molécules chimères qui sont des pro-drogues. Les chercheurs ont démontré que ces molécules nouvelle génération s’accumulent dans les lysosomes des cellules persistantes. Puis, sous l’effet du fer, les espèces bioactives sont effectivement libérées et induisent alors la mort cellulaire par ferroptose dans les différents modèles in-vitro. Le fer joue ainsi le rôle d’activateur chimique et de cible biologique. Ces travaux montrent également qu’il est possible d’induire la ferroptose en manipulant directement le fer, et en particulier le pool libre lysosomal, un nouveau concept de ferroptose active.
Les scientifiques ont évalué et démontré l’action de ces molécules sur cinq lignées cellulaires distinctes d'adénocarcinome du canal pancréatique et organoïdes dérivées de patients. Les résultats obtenus révèlent donc que les pro-drogues testées sont efficaces pour éliminer certaines cellules cancéreuses pancréatiques dérivées résistantes aux médicaments conventionnels. Ces travaux ouvrent la voie au développement de nouvelles stratégies thérapeutiques anticancéreuses impliquant le fer lysosomal et la ferroptose active.
En tant que co-auteur de ce papier, je ne résiste pas à ce clin d’œil historique en précisant que notre illustre fondatrice a publié dans ces mêmes pages il y a 100 ans.
Se réjouit le Pr Alain Puisieux, directeur du Centre de recherche de l’Institut Curie, co-auteur de l’étude
Ces résultats confortent la stratégie choisie de cibler le métabolisme du fer dans les cellules tumorales qui sont impliquées dans les processus métastatiques et les récidives. Ils illustrent concrètement les potentialités de la chemical biology, cette discipline qui vise à utiliser les principes de la chimie physique et la connaissance de la biologie pour avoir un impact sur la médecine. C’est pourquoi, au sein du Centre de recherche de l’Institut Curie, nous avons fait le choix de développer cette expertise à l’avenir prometteur en terme de solutions thérapeutiques pour la cancérologie.
|
Référence : Iron-Sensitive Prodrugs That Trigger Active Ferroptosis in Drug-Tolerant Pancreatic Cancer Cells. Michał Antoszczak, Sebastian Müller, Tatiana Cañeque, Ludovic Colombeau, Nelson Dusetti, Patricia Santofimia-Castaño, Christine Gaillet, Alain Puisieux, Juan Lucio Iovanna, and Raphaël Rodriguez. Journal of the American Chemical Society. https://pubs.acs.org/doi/10.1021/jacs.2c03973. |