- Accueil >
- Les actualités de l'Institut Curie >
- Nouvelles données sur la réponse des cellules sentinelles immunitaires à l’infection par le VIH
Différentes populations de cellules dendritiques (CD) sont présentes dans les tissus en contact avec l’environnement extérieur où elles jouent le rôle de sentinelles. Leurs capacités à détecter les agents pathogènes et à initier des réponses immunitaires spécifiques font qu’elles sont essentielles pour notre système immunitaire. Différentes populations de CD sont également présentes dans le sang, où elles exercent la même fonction envers les agents pathogènes atteignant la circulation sanguine.
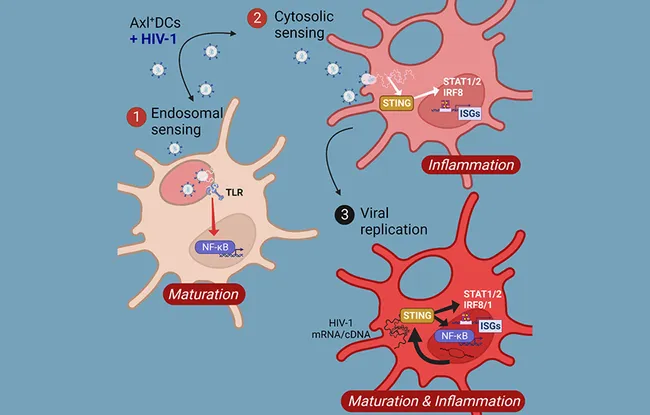
Des études récentes reposant sur l’emploi de techniques sur cellules uniques à grande dimension ont permis d’identifier une nouvelle et quatrième sous-population de CD dans le sang humain, appelée CD Axl+. Lors de l’infection par le VIH, les CD des muqueuses ou du sang, selon la voie de contamination, deviendraient des sortes de chevaux de Troie disséminant le virus dans les tissus de l’hôte. Il y a quelques années, l’équipe de Philippe Benaroch, Cellules myéloïdes et immunité (Inserm U932 / Université Paris-Cité), a montré que parmi les CD du sang, les CD Axl+ sont dotées de capacités uniques de liaison, de réplication et de transmission du VIH-1*. La manière dont les différentes populations de CD du sang détectent, réagissent au VIH-1 et contribuent à l’immunité antivirale restait mal comprise.
Avec son équipe, ils ont mené une étude approfondie des réponses suscitées par les différentes sous-populations de CD humaines dans le sang. À l’aide d’analyses transcriptomiques de sous-populations de CD hautement purifiées à partir du sang, ils ont démontré que la réponse des CD Axl+ au VIH-1 était beaucoup plus robuste et diverse par rapport à celle des autres sous-ensembles de CD du sang. De plus, le VIH-1 induit deux programmes transcriptionnels principaux dans différentes CD Axl+ ; un programme qui conduit à la maturation des CD et à l’activation des lymphocytes T, et un programme qui induit des réponses antivirales (expression des interférons humains de type I et des gènes antiviraux). Grâce au séquençage de l’ARN au niveau de la cellule unique sur les CD Axl+, les auteurs ont révélé que la voie d’entrée du VIH-1 pourrait déterminer le type de réponses déclenchées dans ces cellules et avoir un impact sur la réplication du virus.
Notre étude était techniquement ardue, car les cellules que nous avons étudiées sont très rares, et il est très difficile de trouver de nos jours des patients infectés mais non traités Notre collaboration avec des bio-informaticiens compétents a été déterminante pour la mise en œuvre de méthodes d’analyses qui nous ont permis de comprendre comment différentes sous-populations de cellules dendritiques détectent le VIH et y répondent. Les mécanismes et les voies identifiés ont pu être validés par des expériences in vitro.
Souligne Philippe Benaroch.
Il ajoute également que cette étude fournit des résultats inédits et solides sur le rôle complexe des cellules dendritiques pendant l’infection par le VIH-1. Elle indique aussi que les CD Axl+ ayant été en contact avec le VIH pourraient migrer vers des organes lymphoïdes secondaires. Ainsi, il serait intéressant d’étudier les DC infectées dans des tissus tels que les ganglions lymphatiques, où elles migreraient et interagiraient avec d’autres cellules immunitaires.
Grâce à de nouvelles technologies telles que la transcriptomique spatiale, il serait possible de visualiser réellement comment ces cellules dirigent les réponses immunitaires in situ.
Conclut Philippe Benaroch.