- Accueil >
- Les actualités de l'Institut Curie >
- Sénescence et plasticité des cellules cancéreuses : une relation à haut risque
La capacité des cellules cancéreuses à changer d’identité, au travers d’un phénomène désigné sous le terme de « plasticité cellulaire », constitue un processus d’adaptation jouant un rôle déterminant au cours de la progression des maladies cancéreuses, tant pour la dissémination métastatique que pour la résistance aux traitements.
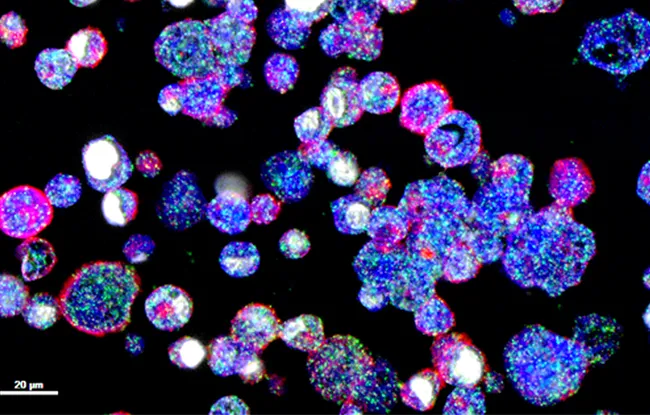
Dans les cancers du sein, cancers d’origine épithéliale, un processus de plasticité cellulaire appelé plasticité épithélio-mésenchymateuse a été observé dans un sous-type particulièrement agressif caractérisé par une signature d’expression génique mésenchymateuse et par des propriétés spécifiques des cellules souches.
Le rôle de la voie cellulaire RAS-MAPK
Dans cette étude dirigée par le Pr Alain Puisieux au sein de l’équipe Chemical Biology (CNRS UMR3666 / Inserm U1143) à l’Institut Curie et par le Dr Anne-Pierre Morel, cheffe de l’équipe EMT and Cancer Cell Plasticity au Centre Léon Bérard, les chercheurs ont observé que ces tumeurs agressives présentaient une activation fréquente de la voie de signalisation mitogénique RAS/MAPK. Ils ont ensuite démontré que l’activation de l’oncogène RAS déclenchait deux types de réponse au sein de la population de cellules épithéliales : certaines cellules entraient en sénescence, processus caractérisé par un arrêt définitif du cycle cellulaire, alors que d’autres s’engageaient dans un processus de plasticité épithélio-mésenchymateuse nécessaire à la transformation maligne.
Une réponse cellulaire à haut risque
Ils ont de plus découvert que la plasticité épithélio-mésenchymateuse dans les cellules en voie de transformation était induite par la sécrétion de cytokines pro-inflammatoires par les cellules sénescentes avoisinantes. Cette observation met en lumière un rôle inattendu de la sénescence. En effet, l’entrée en sénescence, est généralement interprétée de façon déterministe : la cellule soumise au stress oncogénique se sacrifie pour assurer la survie de l’organisme. Les résultats de l’étude montrent qu’il s’agit en réalité d’un phénomène à risque en favorisant la plasticité et la transformation de cellules voisines au travers d’un processus paracrine.
Ces observations renforcent les travaux antérieurs de cette équipe, suggérant un rôle de la plasticité cellulaire au cours des phases initiales de la tumorigenèse. Elles soulignent aussi un paradoxe : un mécanisme supposé de protection de l’organisme -la sénescence en situation de stress- pourrait faciliter les premières étapes de la tumorigenèse. Ensemble, ces résultats ouvrent de nouvelles perspectives de recherche pour mieux comprendre comment se développent les cancers du sein de mauvais pronostic et pour identifier de nouvelles cibles thérapeutiques.
Consortium Institut Curie – Centre Léon Bérard (Team « EMT and Cancer Cell Plasticity”, Centre Léon Brard; and Team “Chemical Biology”, UMR3666 / U1143 – Institut Curie).
Financements : Ces travaux ont été soutenus par des financements de la part de la Fondation pour la Recherche Médicale (FRM), LabEx DEVweCAN, La Ligue Nationale contre le Cancer, le SIRIC LYriCAN, l’Inserm (à travers l’appel d’offre international Associated Laboratory between the Cancer Research Centre of Lyon, France and the Victorian Comprehensive Cancer Centre of Melbourne, Australia), et L’association le Cacer du sein. Parlons-en !
Référence : Hadrien De Blander, Laurie Tonon, Frédérique Fauvet, Roxane M. Pommier, Christelle Lamblot, Rahma Benhassoun, Francesca Angileri, Benjamin Gibert, Raphaël Rodriguez, Maria Ouzounova, Anne- Pierre Morel, Alain Puisieux
Cooperative pro-tumorigenic adaptation to oncogenic RAS through epipthelial-to-mesenchymal plasticity. Science Advances, 2024 Feb 16 doi : https://www.science.org/doi/full/10.1126/sciadv.adi1736