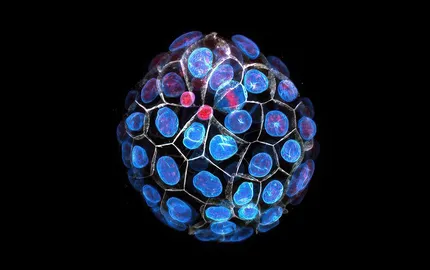
Présentation

Nous voulons comprendre comment l’embryon de mammifère se construit. Pour cela, nous étudions comment les forces qui déforment et déplacent les cellules au sein de l’embryon sont produites. Les candidats naturels sont les molécules d’adhésion, qui collent les cellules ensembles, et le cytosquelette, qui pousse et tire sur ces molécules d’adhésion. Nous utilisons des outils biophysiques pour mesurer les forces, de la microscopie à haute résolution pour observer les changements de forme de l’embryon et la génétique pour perturber le système.
Liste complète des publications
99SEC pour comprendre la biologie du développement (video en français)
Podcast France Inter In Utero Les sept premiers jours et La danse des cellules
Prix de la Fondation Bettencourt Schueller (video en français)
Séminaire Cité des sciences et de l'industrie (video en français)
Prix du CNRS (video en français)
Prix de l'ERC StG (video en anglais)
Séminaire Collège de France (video en anglais)
Séminaire Collège de France (video en anglais)
Séminaire Multiscale integration in biological systems (video en anglais)
Pendant le développement embryonnaire, les cellules utilisent l’information contenue dans le génome pour construire l’organisme. Ceci est accompli par une succession de mouvements morphogénétiques durant lesquels les cellules se divisent, meurent, se déforment et se déplacent. C’est la séquence et la combinaison des mouvements morphogénétiques qui construisent l’architecture spécifique de chaque espèce. Pour comprendre la morphogénèse, nous devons tenir compte de l’évolution, la génétique, la biologie cellulaire et la biophysique. Notre recherche se focalise sur les aspects mécaniques de la morphogénèse des embryons de mammifères.
Morphogénèse de l’embryon préimplantatoire
Le développement préimplantatoire donne naissance au blastocyste qui est composé d’un épithélium squameux enveloppant une cavité et la masse cellulaire interne. Pour former le blastocyste, une séquence de trois mouvements morphogénétiques se produit: la compaction, l’internalisation et la cavitation.
Développement préimplantatoire
Time-lapse du développement préimplantatoire de souris (images prises toutes les 15 min)
Au stade 8-cellule, la compaction est un processus d’adhésion cellulaire qui arrondi l’embryon. Comme l’arrondissement d’une gouttelette, la compaction résulte de l’action d’une tension de surface. Durant le stade 8-cellule, la tension à la surface des cellules augmente lorsque le cortex d’acto-myosine augmente sa contractilité. Au même moment, l’augmentation de la contractilité des cellules démarre des vagues de contractions périodiques. Voir Pulsatile cell-autonomous contractility drives compaction in the mouse embryo.
Compaction
Time-lapse du la compaction de l’embryon de souris (images prises toutes les 15 min)
Au stade 16-cellule, les blastomères peuvent se retrouver a l’extérieur ou à l’intérieur de l’embryon, entourées par les cellules voisines. La division de 8- à 16-cellule est cruciale dans le positionnement des cellules. La division peut être orientée de façon à pousser une des cellules filles vers l’intérieur de l’embryon. La division peut également être asymétrique en distribuant des molécules distinctes aux deux cellules filles et ainsi leur procurer des propriétés contractiles différentes. Voir Asymmetric division of contractile domains couples cell positioning and fate specification. Ces différentes propriétés contractiles déclenchent l’auto-organisation des cellules de l’embryon en cellules internes ou externes. Voir Adhesion functions in cell sorting by mechanically coupling the cortices of adhering cells. Ce positionnement des cellules contrôle leur programme génétique et la différentiation en tissus embryonnaire ou extra-embryonnaire. La mécanique des cellules semble influer sur cette différentiation. Voir Asymmetric division of contractile domains couples cell positioning and fate specification.
Internalisation
Timelapse de l’internalisation d’un doublet chimérique de cellules exprimant un marqueur de l’actine (LifeAct) dans des couleurs différentes (images prises toutes les 15 min).
Au stade 32-cellule, une cavité se forme entre les cellules externes et internes. Au départ de ce processus, de multiples cavités se créent puis fusionnent en une seule cavité. Durant la croissance des cavités, les contacts entre les cellules internes et externes se brisent.
Ondes corticales de contractions périodiques
Pendant la morphogénèse, la contractilité d’acto-myosine est souvent un des moteurs principaux des changements de forme des cellules et des tissus. Sur des échelles de temps plutôt longues, ces changements aparaissent continus, mais, en réalité, les contractions qui les contrôlent sont pulsées et se répètent de façon périodique. Il est intéressant de noter que ce phénomène peut être observe chez d’autres animaux que la souris, comme le vers, la mouche et la grenouille.
Contractions périodiques
Timelapse de contractions périodiques d’un embryon au stade 8-cellule en absence de calcium (image prise toutes les 5 s).
Ces contractions périodiques sont, en effet, courantes dans le développement animal et peuvent adopter des formes différentes. Chez la souris, les blastomères, dès le stade 8-cellule, créent des ondes corticales de contractions périodiques. Voir Pulsatile cell-autonomous contractility drives compaction in the mouse embryo.
Ondes corticales de contractions périodiques
Timelapse d’ondes corticales de contractions périodiques (images prises toutes les 5 s). Image en contraste de phase à gauche, LifeAct-GFP au milieu et membrane plasmique avec la courbure codée en fausses couleurs.
Après une division asymétrique, les ondes corticales de contractions périodiques peuvent être utilisées pour prédire quelle cellule est prédisposée à l’internalisation et à se différencier en tissue embryonnaire. En effet, les cellules qui deviendront extra-embryonnaires ont une contractilité plus faible. Voir Asymmetric division of contractile domains couples cell positioning and fate specification.
Periodic cortical waves after asymetric division
Timelapse d’ondes corticales de contractions périodiques (images prises toutes les 5 s).
Blastomères au stade 16-cellule après division d’un blastomère isolé au stade 8-cellule. La membrane plasmique est montrée en magenta et LifeAct-GFP en vert. Le blastomère non-polarisé montre des contractions amples tandis que la cellule-soeur polarisée reste calme. Le blastomère polarisé va envelopper la cellule non-polarisée qui deviendra le tissu embryonnaire.
Mesurer les propriétés mécaniques des cellules de l’embryon de mammifère
Des micropipettes peuvent être facilement combinées avec un microscope confocal à haute résolution afin d’établir un rapport entre les propriétés mécaniques et les processus sub-cellulaires. Voir Adhesion functions in cell sorting by mechanically coupling the cortices of adhering cells. L’aspiration dans une micropipette peut être utilisée pour mesurer la tension de surface ou la viscosité des cellules ou des tissus. Voir Pulsatile cell-autonomous contractility drives compaction in the mouse embryo.
Photo d’un embryon au stade 8-cellule tenu par une micropipette lors d’une experience de cartographie des tensions de surfaces (à gauche). Les tensions de surface γcm sont mesurées séquentiellement pour tous les blastomères de l’embryon en trouvant la pression critique donnant une déformation de taille Rp et en mesurant le rayon de courbure Rc. Les tensions de surface γcm des blastomères en contact sont ensuite utilisés pour calculer les tensions des contact cellulaires γcc en prenant en compte les angles de contact θ.
Un système à double micropipette permet de mesurer la force de couplage entre les cellules in vitro. Voir Dual pipette aspiration: a unique tool for studying intercellular adhesion.
Mesure de force de séparation
Deux progéniteurs de mésoderme de poisson zèbre sont mis en contact à l’aide de deux micropipettes, puis sont séparés en éloignat les micropipettes l’une de l’autre tout en appliquant des pressions de plus en plus grandes avec la micropipette de gauche.
Le système à double micropipette permet aussi d’estimer les contributions relatives de l’adhésion et la contractilité dans la formation des contacts cellulaires, ainsi que les propriétés élastiques du cortex d’actom-myosine. Voir Adhesion functions in cell sorting by mechanically coupling the cortices of adhering cells et Active elastic thin shell theory for cellular deformations.